C53 Злокачественное новообразование шейки матки, МКБ-10
- C53.0 Внутренней части
- C53.1 Наружной части
- C53.8 Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций
- C53.9 Шейки матки неуточненной части
Отредактировано: 02.04.2024
д.м.н., проф. Кузнецов В.В., д.м.н., проф. Козаченко В.П.,
д.м.н. Лебедев А.И., к.м.н. Морхов К.Ю., к.м.н. Грицай А.Н.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Эпидемиология. Этиология и патогенез. Клинические проявления рака шейки матки. Скрининг и ранняя диагностика. Диагностика. Классификации рака шейки матки. Лечени
Рак шейки матки — одна из наиболее частых злокачественных опухолей женских гениталий. По данным Всемирной организации здравоохранения, ежегодно в мире РШМ заболевают свыше 500 тыс. женщин (из них 79% приходится на развивающиеся страны), а умирают от него около 200 тыс. женщин. Несмотря на успехи в ранней диагностике и лечении, РШМ входит в число наиболее часто встречающихся злокачественных новообразований и занимает 5 место в структуре всей онкологической патологии.
Эпидемиология
В развивающихся странах заболеваемость РШМ занимает первое место среди новообразований гениталий, в экономически развитых странах — третье после РТМ и РЯ. В Африке, Центральной и Южной Америке, Азии (за исключением Японии) на долю РШМ приходится 20–30% всей онкологической патологии у женщин, в Северной Америке, Австралии, Северной и Западной Европе — 4–6%.
Уровень заболеваемости РШМ различается не только на различных континентах, но и на территории каждого из них. При анализе заболеваемости РШМ за 1970–1990 гг. в 10 регионах Европы выявлены географические различия (от 12,60/0000 в провинции Наварра в Испании до 820/0000 в департаменте Нижний Рейн в Германии). В целом на указанных территориях ежегодно отмечается снижение заболеваемости РШМ в среднем на 3% (Levi F. et al., 2000). Следует отметить, что самая низкая заболеваемость РШМ (2,60/0000) наблюдается в Китае (Chen J. et al., 2000).
Заболеваемость РШМ в различных этнических группах, объединенных одним ареалом проживания, неодинакова. В Северной Америке и ЮАР РШМ чаще встречается у чернокожих женщин, чем у белых (Behbarht K. et al., 2001). Изучение 4 этнических групп в Чикаго выявило самую высокую заболеваемость РШМ у пуэрториканок и чернокожих женщин.
В начале 60-х гг. ХХ в. на территории СССР РШМ был одним из наиболее часто встречающихся онкологических заболеваний (более 13% больных злокачественными новообразованиями). К 1970 г. удельный вес РШМ в структуре онкологической заболеваемости населения страны снизился до 7,9%, и со второго места (после рака желудка) он переместился на четвертое (Заридзе Д.Г., 1992).
Сравнительный анализ по странам бывшего СССР за 1985–1998 гг. показал, что в структуре заболеваемости РШМ находится на 2–7 местах (Трапезников Н.Н. с соавт., 2000). Самая низкая заболеваемость в Туркмении — 8,50/0000; на Украине и в Киргизстане она достигает 13,1–13,60/0000. Темпы снижения заболеваемости РШМ также различны. За указанный период в Таджикистане она снизилась на 4,1%, в Киргизии — на 40,2%. М.П. Креветенко с соавт. (2000), изучив динамику заболеваемости РШМ за 30 лет в г. Киеве, показали, что уровень заболеваемости снизился на 30% (с 21 до 140/0000). Вместе с тем в 90-х гг. показатели заболеваемости остаются достаточно стабильными и составляют 14,5–14,70/0000.
В структуре заболеваемости населения России злокачественными новообразованиями в 2000 г. РШМ занимает 5 место и составляет 5,3%. Среди онкогинекологической патологии РШМ прочно удерживает 2 место (после РТМ). Стандартизованный показатель заболеваемости РШМ в 2000 г. по Российской Федерации составил 11,20/0000 с колебаниями от 5,6–6,90/0000 в Чукотском автономном округе и Мурманской области до 22,8–24,80/0000 в Читинской области и Республике Тува. Показатель летальности в Российской Федерации — 5,10/0000 (Давыдов М.И. с соавт., 2002). Существенной тенденцией в России за период 1990–2000 гг. является снижение удельного веса РШМ в общей структуре онкологических новообразований (с 6,5 до 5,3%). К сожалению, эта динамика отнюдь не свидетельствует об улучшении качества проводимого цитологического скрининга. Доля больных, выявленных при профилактических осмотрах в 2000 г., снизилась до 23,9%. Достаточно редким явлением остается диагностика преинвазивного РШМ — около 11% всех диагностированных опухолей шейки матки (ШМ). В 2000 г. РШМ III-IV стадий выявлен у 39,1% больных, несмотря на визуальную локализацию заболевания (Давыдов М.И. с соавт., 2002). Высоким остается показатель летальности на первом году с момента установления диагноза (20,5%), что свидетельствует о поздней диагностике РШМ и не всегда адекватном лечении.
РШМ наиболее часто выявляется у женщин старше 40 лет. У пациенток до 35 лет частота возникновения РШМ, по данным различных авторов, составляет от 1,6 до 10%. Однако в последние годы на фоне общего снижения заболеваемости РШМ в некоторых странах наблюдается ее рост среди женщин молодого возраста (Fischer U., 2001). Анализ частоты возникновения РШМ в Европе за 30 лет (Levi F. et al., 2000) показал, что с начала 70-х гг. ХХ в. заболеваемость среди женщин до 39 лет увеличилась незначительно, достигнув в последние годы 20% (при этом 4,8% — в возрасте до 29 лет). В России у женщин молодого возраста отмечается рост заболеваемости РШМ в среднем на 2% в год на фоне ее снижения в остальных возрастных группах.
Таким образом анализ приведенных эпидемиологических данных позволяет выявить следующие крайне неблагоприятные тенденции последнего десятилетия XX в. Во-первых, при относительно стабильной заболеваемости РШМ в целом, растет заболеваемость женщин репродуктивного возраста. Во-вторых, увеличивается частота РШМ III-IV стадий.
В связи с этим требуют пересмотра скрининговые программы по выявлению групп риска РШМ на основе современных методов цитологического и вирусологического исследований, а также усовершенствование и широкое внедрение в клиническую практику схем лечения распространенных форм РШМ.
Этиология и патогенез
В этиологии и патогенезе РШМ ведущую роль играют экзогенные факторы. До настоящего времени нет данных о том, что существует наследственная предрасположенность к РШМ. Вместе с тем большое количество исследований доказывают влияние половой жизни женщин на возникновение РШМ. Известно, что РШМ практически не встречается у девственниц и монахинь. Факторами риска РШМ считаются раннее начало половой жизни, ранние первые роды, частая смена половых партнеров, отказ от барьерных контрацептивов. Высокая заболеваемость РШМ отмечается среди женщин из малообеспеченных слоев населения, особенно в странах с низким социально-экономическим уровнем жизни. Имеются убедительные данные о повышении риска РШМ у курящих женщин. Дискутируется вопрос о влиянии оральных контрацептивов и различных инфекций, передаваемых половым путем.
В настоящее время неоспоримым этиопатогенетическим фактором дисплазии и РШМ считается генитальная папилломавирусная инфекция. Приоритетными в этом направлении являются молекулярно-биологические исследования, проведенные немецкими учеными под руководством zun Hauzen (1974, 1983, 1985, 1991). Ученым удалось выделить клеточные линии, полученные из опухолевой ткани шейки матки, что позволяет проводить сравнительный анализ клеточных линий и опухолей, персистенцию вирусной ДНК, а также изучить функцию и экспрессию генов вируса папилломы человека (ВПЧ). Установлено, что в процессе опухолевой трансформации нарушается регуляция транскрипции вирусных онкогенов (zun Hauzen Н., 1991).
ВПЧ персистирует в эпителии шейки матки. Наиболее уязвимым участком является зона перехода многослойного плоского эпителия в цилиндрический эпителий. Самый чувствительный тест для выявления ВПЧ — полимеразная цепная реакция с типо— и видоспецифическими праймерами. Этот тест позволяет идентифицировать ВПЧ в опухолевых клетках шейки матки в 35–100% наблюдений (Bosch F. et al., 1995; Самойлова Э.В., 1996).
В настоящее время идентифицировано более 100 типов ВПЧ, из которых 34 поражают аногенитальную область. Все изученные типы ВПЧ по способности вызывать дисплазию и РШМ условно разделены на группы высокого и низкого риска. К первой группе относят 16, 18, 31, 33, 48 и 56 типы, ко второй — 6, 11, 42, 43, 44. ВПЧ 6 и 11 типов вызывают остроконечные кондиломы, часто определяются при легкой и умеренной дисплазии и редко связаны с РШМ. При РШМ чаще выявляют ВПЧ 16 (50–70%) и 18 (10–20%) типов (De Villiers E.T., 1994).
Большинство исследователей считает, что инфицирования ВПЧ недостаточно для индукции опухолевого роста, и отмечают роль кофакторов (участвующих в регуляции клеточного цикла и дифференцировки клеток) в реализации вирусного канцерогенеза.
По своей генетической структуре все известные типы ВПЧ весьма сходны. Генетический материал вируса представлен ДНК, содержащей 9 генов. Два гена кодируют структурные белки вириона L1 и L2, а остальные (Е1-Е7; т.н. ранние гены) — белки, необходимые для осуществления характерных функций данного вируса. Кроме того, в составе вирусного генома имеется регуляторный участок — URR (upstream regulatory region).
РШМ является уникальной моделью вирусного канцерогенеза, для которой:
— доказана ассоциация неоплазии с ВПЧ;
— определены основные факторы риска и пути передачи инфекции;
— охарактеризованы трансформирующие вирусные гены и возможные механизмы их действия;
— идентифицированы отдельные клеточные гены, нарушение функций которых может приводить к возникновению благоприятных условий для реализации трансформирующего потенциала вирусных онкогенов (стимуляция клеточной пролиферации, мутагенез с последующим развитием инвазивного, метастазирующего новообразования).
Необходимо подчеркнуть, что вирусный геном как в эписомальной, так и в интегрированной форме может быть функционально неактивным. Его активизация является важнейшим элементом развития опухолевого процесса. Хотя этот процесс мало изучен, тем не менее отдельные экзогенные кофакторы установлены. Это курение и сопутствующие вирусные инфекции, прежде всего, вирус простого герпеса.
Начальные этапы патогенеза неопластического процесса в эпителии шейки матки связаны с онкопротеинами ВПЧ (в основном Е6 и Е7), которые воздействуют на функцию ключевых опухолевых супрессоров — p53 и pRb (Burgess A.W., Lorincz A., 2000). Это сопровождается нарушением контроля жизнедеятельности клеток, появлением хромосомной нестабильности, анеуплоидии. Одними из маркеров полиморфизма генов и перестроек генома в клетках опухоли являются некодирующие повторяющиеся последовательности, сцепленные с генами, — мини-микросателиты. При РШМ в 15% выявлены дисбаланс и утрата отдельных аллелей микросателитного повтора в локусе генов ФНО на коротком плече 6 хромосомы. Для ранних стадий РШМ характерен полиморфизм микросателитов на коротком плече 3 хромосомы 3р, повторяющихся на отрезке 3рter–3р12 (Chung T.K. et al., 2000). E. Sheets et al. изучали процесс расщепления хроматина как показатель апоптоза и выявили, что нарушение дифференцировки клеток шейки матки связано со снижением активности апоптоза. Злокачественная трансформация обычно сопровождается деструкцией гена E2 с последующим нарушением регуляции экспрессии Е6 и Е7. Разрушение гена Е2 приводит к появлению ВПЧ-трансформированных клеток, которые менее подвержены апоптозу и, следовательно, склонны к образованию опухоли шейки матки.
Ряд авторов считает, что наличие ВПЧ и связанных с ними биологических особенностей эпителия шейки матки являются основанием для формирования групп риска.
Клинические проявления
Существует длительный период (10–15 лет), в течение которого дисплазия шейки матки трансформируется в преинвазивный, а затем в инвазивный РШМ. В 30% наблюдений отмечается спонтанная регрессия дисплазии и даже рака in situ. Дисплазия и преинвазивный РШМ не имеют патогномоничных клинических проявлений и диагностируются только морфологически. Последний может быть выявлен при гистологическом исследовании на визуально неизмененной шейке матки при дисплазии. У большинства больных преинвазивный или микроинвазивный РШМ возникает в зоне трансформации.
Ранними проявлениями болезни являются обильные водянистые бели и “контактные” кровянистые выделения из половых путей. У женщин репродуктивного периода жизни возможно появление ациклических кровянистых выделений из половых путей, в постменопаузе — периодических или постоянных. При значительном местно-регионарном распространении опухоли пациентки жалуются на боли, дизурию и затруднения при дефекации. При больших некротизированных опухолях выделения из половых путей сопровождаются неприятным запахом. В запущенных случаях образуются ректовагинальные и мочепузырно-вагинальные свищи, могут пальпироваться метастатически измененные паховые и надключичные лимфатические узлы.
У 70–80% больных инвазивным РШМ диагностируется плоскоклеточный рак, у 10–20% — аденокарцинома и у 10% — низкодифференцированный рак. Другие гистологические типы злокачественных опухолей шейки матки составляют не более 1%.
Клинические проявления РШМ в определенной степени зависят от топографо-анатомических особенностей роста опухоли. Большинство опухолей локализуются на эктоцервиксе, имеют экзофитный рост и достигают значительного объема. Реже опухоль имеет эндофитный рост. При этом опухоль часто переходит на цервикальный канал шейки матки, в то время как при экзофитном росте чаще отмечается переход опухоли на влагалище. Нередко встречаются опухоли со смешанной формой роста, имеющие экзо— и эндофитный компоненты. Как правило, только при I стадии РШМ удается установить первоначальные особенности анатомического роста первичной опухоли.
РШМ метастазирует лимфогенно и гематогенно. Переход опухоли от местно-инфильтративного роста к лимфорегионарному распространению прогностически неблагоприятен. К сожалению, значительная часть больных РШМ при первичном обращении имеют лимфогенные метастазы. Лимфогенное метастазирование РШМ условно можно разделить на несколько этапов. I этап лимфогенного метастазирования — наружные, внутренние подвздошные и запирательные лимфатические узлы, II этап — общие подвздошные, III этап — поясничные и IV этап — лимфатические узлы средостения и надключичных областей. При метастатическом поражении лимфатических узлов таза можно наблюдать ретроградные метастазы в паховые лимфатические узлы.
Ведущим фактором, запускающим механизм лимфогенного метастазирования, является глубина инвазии опухоли. При инвазии опухоли до 1 мм метастазов в регионарных лимфатических узлах не бывает. При инвазии опухоли до 3 мм (IА1 стадия) лимфогенные метастазы обнаруживаются всего у 1% больных, в то время как при глубине инвазии 3–5 мм (IА2 стадия) частота лимфогенных метастазов составляет уже 5–8%. Дальнейший рост опухоли приводит к проявлению раковых микроэмболов в лимфатических сосудах, что резко увеличивает частоту лимфогенных метастазов. По данным различных авторов, частота лимфогенных метастазов при РШМ IВ стадии составляет 15–18%, II стадии — 25–30%, а при III стадии достигает 50–60%. Следует отметить, что для РШМ в течение длительного времени характерно местное или местно-регионарное распространение.
Местно-регионарное распространение опухоли ведет к гематогенному метастазированию. Наиболее часто при РШМ гематогенные метастазы возникают в легких, печени и костях. Гематогенные метастазы РШМ без лимфогенных встречаются крайне редко.
Скрининг и ранняя диагностика
В настоящее время популяционный цитологический скрининг представляет собой идеальную модель вторичной профилактики РШМ. Эффективность любой скрининговой программы определяется ее практической надежностью и способностью снижать заболеваемость и смертность. Кроме того, используемые скрининг-тесты должны быть простыми для выполнения, диагностически надежными и дешевыми. Все изложенное в полной мере можно отнести к популяционному цитологическому скринингу РШМ. Программы популяционного цитологического скрининга РШМ, применяемые с 40-х гг. ХХ в., привели к значительному снижению смертности от РШМ. Анализ результатов скрининга показал взаимосвязь между интенсивностью скрининга и снижением заболеваемости. Внедрение цитологического скрининга снизило заболеваемость и смертность от РШМ на 20–30% в Англии, Исландии, Финляндии, Швеции, Дании. При ежегодном скрининге женщин в возрасте 20–64 лет возможно снижение риска развития РШМ на 90%. Снижение смертности от РШМ при широком внедрении популяционного цитологического скрининга достигается за счет выявления дисплазии и внутриэпителиального РШМ, снижения частоты инвазивных форм РШМ. Точность цитологического исследования, по данным различных авторов, колеблется от 91,0 до 97,6%. Снижают эффективность цитологического исследования неправильная техника взятия мазков, недостаточная квалификация врачей и лаборантов. Важными факторами повышения эффективности скрининга РШМ являются регулярность его проведения (с интервалами 1–5 лет) и охват бóльшей части популяции (70–80%). Ряд авторов считает, что значительные возможности улучшения цитологической диагностики скрыты в усовершенствовании морфологических критериев и стандартизации цитологических заключений.
При анализе специальной литературы выявляются 2 принципиально противоположные точки зрения на организацию цитологического скрининга РШМ. Большинство национальных скрининг-программ в экономически развитых странах мира направлены на профилактическое обследование практически всей популяции. Наряду с этим продолжаются поиски оптимальных групп риска с целью проведения селективного обследования. Необходимость уменьшить число женщин, подлежащих селективному цитологическому скринингу, определяется следующими факторами. Во-первых, экономические предпосылки. Во-вторых, выявленные факторы риска РШМ. В-третьих, концепция о группах риска. Развертывание популяционных скрининг-программ связано с большими экономическими затратами, определенным периодом времени, необходимым для этого, созданием централизованных цитологических лабораторий и оснащением их современным оборудованием, а также подготовкой квалифицированных врачей-цитологов и лаборантов.
Главная задача цитологического скрининга — выявление дисплазии и преинвазивного РШМ. В зависимости от выраженности клеточной атипии, нарушения созревания клеток и числа митозов различают легкую, умеренную, тяжелую дисплазию и преинвазивный РШМ (рис. 1). Учитывая отсутствие четких морфологических критериев различия тяжелой дисплазии и преинвазивного РШМ, R. Richart (1976) предложил использовать термин цервикальная интраэпителиальная неоплазия (CIN) и выделил 3 ее степени. CIN I соответствует слабой дисплазии, CIN II — умеренной, CIN III — тяжелой дисплазии и преинвазивному РШМ. В Национальном институте рака (США) цитологи и клиницисты совместно разработали классификацию, согласно которой дисплазию и преинвазивный РШМ обозначают термином “плоскоклеточные интраэпителиальные изменения” (SIL) низкой и высокой степени. SIL низкой степени соответствует легкой дисплазии, а SIL высокой степени включает в себя умеренную и тяжелую дисплазию, а также преинвазивный РШМ.
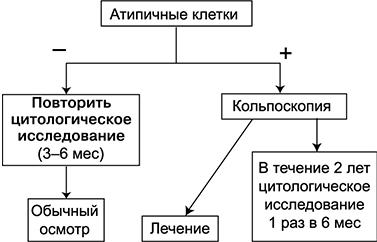
Рисунок 1. Порядок обследования при обнаружении атипичных клеток плоского эпителия
По данным Y. Yoshida et al. (2001), чувствительность скрининг-теста РШМ достигает 94,7%, специфичность — 98,9%.
Исследования последних лет показали высокую частоту ошибок при проведении цитологического скрининга — 40–90% ложноотрицательных и ложноположительных результатов (Myers E.R. et al., 2000). До сих пор дискутируется вопрос о сроках проведения цитологического скрининга. Для решения этих проблем актуальна разработка новых подходов и программ скрининга РШМ. Увеличить эффективность цитологического скрининга возможно при усовершенствовании методики обследования и полном устранении субъективной оценки цитологических результатов с помощью новых автоматизированных компьютерных технологий.
Полностью автоматизированных систем пока не существует, однако полуавтоматизированная система для первичного цитологического скрининга разработана в Национальном институте рака (США) на базе американской компании “Papnet”. Система “Papnet” представляет собой новое поколение систем компьютерного анализа цитологического изображения. При обработке данных определяются измененные клетки в мазках, окрашенных по Папаниколау. Эта система, в отличие от других, не использует алгоритмов и пригодна для исследования стандартных многослойных мазков.
В настоящее время существуют скрининговые программы диагностики ВПЧ-инфекции. По мнению Bannasch P. et al. (1998), если всех женщин обследовать на носительство ВПЧ и в отношении носительниц ВПЧ применить адекватные профилактические меры, то заболеваемость РШМ снизится до нуля. Однако эта точка зрения дискутабельна.
Методы диагностики ВПЧ разделяют на классические (цитологический метод, гистологическое исследование биоптатов, кольпоскопия, определение антител к ВПЧ) и современные (неамплификационные — Southern blot, Dot blot, гибридизация in situ, ПЦР и амплификационные — Hybrid Capture).
При выявлении в цитологических мазках патогномоничных признаков ВПЧ (койлоцитоз в сочетании с гипер— и паракератозом) необходимо проведение кольпоскопического исследования для выявления дисплазии. Кольпоскопия позволяет оценить размеры поражения и его локализацию, но о характере поражения можно говорить лишь предположительно.
Цитологический метод имеет ряд недостатков. Во-первых, он позволяет диагностировать только клиническую и субклиническую формы ВПЧ-инфекции. Во-вторых, чувствительность этого метода при выявлении ВПЧ-инфекции варьирует от 59 до 80%.
В настоящее время для диагностики ВПЧ используются 2 основных молекулярно-биологических теста. Это ПЦР и Hybride Capture System II, основанный на ПЦР, который обнаруживает от 10 до 100 копий генома ВПЧ. Одним из условий эффективности последнего является подбор оптимальных нуклеотидных праймеров.
По данным различных авторов, ДНК ВПЧ определяется у 3–10% здоровых женщин, при различных видах кондилом — у 50–82%, при доброкачественных заболеваниях шейки матки — у 12–30%, при дисплазии шейки матки — у 19–89%, при преинвазивном РШМ — у 53–89%.
Учитывая недостатки каждого диагностического метода, новые первичные скрининговые программы должны учитывать несколько факторов риска и включать различные методы диагностики. При использовании цитологического, цервикографического методов и теста с ацетиловой кислотой чувствительность скрининга достигла 76,9% (Croiye H.S. et al., 2001). Комбинация вирусологических и цитологических методов (в этой последовательности) компенсирует недостатки каждого из них и позволяет значительно повысить эффективность скрининга (Ratnano S. et al., 2000). В последнее время появились новые тесты, основанные на иммуногистохимических, цитометрических, иммунологических исследованиях. До сих пор не определены специфические для РШМ биологические опухолевые маркеры, но исследования в этом направлении продолжаются.
Диагностика
Профилактическое обследование женщины включает визуальный осмотр наружных половых органов, влагалища, влагалищной части шейки матки, бимануальное ректовагинальное исследование и цитологическое исследование мазков с экто— и эндоцервикса. При выявлении фоновой патологии шейки матки дополнительно проводится кольпоскопия, а при необходимости — биопсия всех подозрительных участков шейки матки. Выскабливание цервикального канала дополняет ряд диагностических мероприятий, которые позволяют своевременно диагностировать дисплазию, преинвазивный и микроинвазивный РШМ (рис. 2).

Рисунок 2. Диагностический алгоритм
Наиболее полную морфологическую картину изменений дает гистологическое исследование серийно-ступенчатых срезов послеоперационных препаратов после расширенной ножевой биопсии, конизации или ампутации шейки матки. При инвазивном РШМ после гистологической верификации диагноза последующие диагностические мероприятия направлены на установление степени распространенности опухоли и стадирование заболевания. С этой целью больным выполняются УЗИ органов брюшной полости и малого таза, забрюшинных лимфатических узлов таза и поясничной области, мочевыводящих путей, рентгенологическое исследование органов грудной клетки, цистоскопия, ректороманоскопия. При необходимости выполняют КТ, урографию, радиоизотопное исследование функции почек, рентгенографию костей, рентгеноконтрастное исследование кишечника, лапароскопию (рис. 3).

Рисунок 3. Исследования, необходимые для определения клинической стадии инвазивного РШМ
По данным различных авторов, ошибки при клиническом стадировании РШМ достигают 36%.
Следует отметить, что информация о размере, локализации, местном и регионарном распространении опухоли, отдаленных метастазах необходима для выбора рациональной тактики лечения больных РШМ.
Возможности комплексной диагностики РШМ расширились благодаря внедрению современных медицинских технологий (эхографии, КТ, МРТ). Особые надежды в уточняющей диагностике РШМ в последние годы связаны с эхографией. Совершенствование аппаратуры и методических приемов, совместное применение трансабдоминальной, трансвагинальной эхографии и допплерографии приобрели большое значение на первом этапе диагностики для уточнения местного распространения РШМ (Чекалова М.А. с соавт., 2000). Вместе с тем возможности трансабдоминальной и трансвагинальной сонографии при малых размерах опухоли ограничены. Совместное использование КТ и МРТ весьма ценно для определения инвазии в смежные органы и выявления метастатического поражения забрюшинных лимфатических узлов.
Применение МРТ в практической медицине привело к качественному скачку в диагностике распространенности РШМ. Преимуществами метода являются многоплоскостная визуализация, высокий естественный тканевой контраст, визуализация всего таза. При РШМ МРТ наиболее эффективна для визуализации инвазивной карциномы. МРТ обычно используется после верификации диагноза для стадирования опухолевого процесса. Этот метод позволяет выявлять распространение опухоли на тело матки и параметральную клетчатку, а также визуализировать незначительно увеличенные тазовые лимфатические узлы. МРТ позволяет выявлять опухоли небольших размеров c инвазией более 0,5 см, а также наличие инвазии в параметральную клетчатку (84%), инфильтрации крестцово-маточных связок и мягких тканей промежности (87%), что не всегда возможно при эхографии (Fujiwara K. et al., 2000). МРТ высокоэффективна для визуализации дилятации мочеточников при их сдавлении параметральными инфильтратами и может с успехом заменять экскреторную урографию.
МРТ позволяет оптимизировать планирование лучевой терапии РШМ, а также является наиболее информативным диагностическим методом оценки эффективности лечения и выявления рецидивов РШМ. Choi J.I. et al. (2000) выделили 4 группы больных, которым с целью уточняющей диагностики необходимо проведение МРТ и/или КТ для:
1) определения первичных размеров опухоли,
2) выявления распространения опухоли на стенки таза,
3) выявления метастазов в лимфатические узлы,
4) выявления отдаленных метастазов.
Применение эндовагинальных и трансректальных магнитно-спиральных трубок увеличивает диагностическую ценность МРТ при определении параметральных инфильтратов.
Классификации рака шейки матки
Унификация диагностических подходов и стандартизация методов лечения в сочетании с индивидуализацией специальной терапии РШМ возможны благодаря разработанным классификациям, которые позволяют определить клиническую стадию болезни (классификация FIGO, 1995 г.; TNM, 1998 г.) и морфологическое строение опухоли (Морфологическая классификация предопухолевых заболеваний и злокачественных опухолей ШМ. ВОЗ, МКБ-О, 1990).
Таблица 1
Классификация РШМ по стадиям и распространенности опухолевого процесса (FIGO, TNM)
| TNM | FIGO | Стадиям и распространенность | |
| Tx | — | Недостаточно данных для оценки первичной опухоли | |
| T0 | — | Первичная опухоль не определяется | |
| Tis | Стадия 0 | Рак in situ, преинвазивный рак (эти случаи не входят в статистику заболеваемости РШМ) | |
| T1 | Стадия Iа) | Опухоль ограничена маткой (распространение на тело матки не учитывается) | |
| T1a | IA | Диагноз ставится только при гистологическом исследовании | |
| T1a1 | IA1 | Глубина инвазии не более 3 мм (микроинвазивный рак) | |
| T1a2 | IA2 | Глубина инвазии более 3 мм, но не более 5 мм (измеряется от базальной мембраны поверхностного или железистого эпителия). Горизонтальное распространение не должно превышать 7 мм, в противном случае опухоль следует относить к стадии IB | |
| T1b | IB | Глубина инвазии более 5 мм | |
| T1b1 | IB1 | Размеры опухоли не более 4 см | |
| T1b2 | IB2 | Размеры опухоли более 4 см | |
| T2 | Стадия IIб) | Опухоль, распространившаяся за пределы матки без перехода на стенки таза и поражения нижней трети влагалища | |
| T2a | IIA | Без вовлечения параметрия | |
| T2 | IIB | С вовлечением параметрия | |
| T3 | Стадия IIIв) | Опухоль, вовлекающая стенки таза (при ректальном исследовании отсутствует пространство между опухолью и стенкой таза) или нижнюю треть влагалища, а также все случаи РШМ с гидронефрозом и нефункционирующей почкой | |
| T3a | IIIA | Вовлечение нижней трети влагалища | |
| T3b | IIIB | Распространение на стенку таза или гидронефроз и нефункционирующая почка | |
| — | Стадия IVг) | Опухоль, распространившаяся за пределы таза или прорастающая слизистую мочевого пузыря или прямой кишки (буллезный отек не позволяет отнести опухоль к стадии IV) | |
| T4 | IVA | Прорастание мочевого пузыря или прямой кишки | |
| M1 | IVB | Отдаленные метастазы | |
| Состояние регионарных узлов | Отдаленные метастазы | ||
| Nx | Недостаточно данных для оценки | M0 | Отдаленные метастазы отсутствуют |
| N0 | Признаков поражения регионарных лимфоузлов нет | M1 | Имеются отдаленные метастазы |
| N1 | Метастазы в регионарных лимфоузлах | ||
a) Стадии IA1 и IA2 диагностируют на основании результатов гистологического исследования операционных препаратов преимущественно после конизации шейки матки. При конизации должна быть удалена вся измененная влагалищная часть шейки матки. Если опухоль определяется макроскопически, следует относить ее к стадии T1b. Глубина инвазии определяется от базальной мембраны, независимо от того, исходит опухоль из поверхностного эпителия или из железистого. Выявление опухолевых эмболов в сосудах не меняет стадии, но должно быть отражено в заключении гистологического исследования, поскольку может повлиять на тактику лечения. Распространение на тело матки не учитывается, поскольку переход опухоли на тело матки до операции выявить очень трудно.
б) При вовлечении параметрия стадия III диагностируется тогда, когда инфильтрат в параметрии имеет узловую форму и доходит до стенки таза. В остальных случаях диагностируется стадия IIB. Следует подчеркнуть, что при гинекологическом исследовании судить о природе инфильтрата (воспалительной или опухолевой) невозможно.
в) При гидронефрозе и нефункционирующей почке, обусловленных сдавлением мочеточника опухолью, диагностируют стадию III.
г) О врастании в мочевой пузырь говорят тогда, когда складки слизистой фиксированы к опухоли, что подтверждается при пальпации через переднюю стенку влагалища во время цистоскопии. Если при цитологическом исследовании мочи или смывов из мочевого пузыря обнаружены опухолевые клетки, производят его биопсию

Рисунок 4. Рак шейки матки IA стадии (FIGO) (Barakat et al., 2002)

Рисунок 5. Рак шейки матки IA1 стадии (FIGO) (Barakat et al., 2002)

Рисунок 6. Рак шейки матки IA2 стадии (FIGO) (Barakat et al., 2002)

Рисунок 7. Рак шейки матки IB1 стадии (FIGO) (Barakat et al., 2002)

Рисунок 8. Рак шейки матки IB1 стадии (FIGO) (Barakat et al., 2002)

Рисунок 9. Рак шейки матки IB2 стадии (FIGO) (Barakat et al., 2002)

Рисунок 10. Рак шейки матки IIA и IIB стадий (FIGO) (Barakat et al., 2002)

Рисунок 11. Рак шейки матки IIIA и IIIB стадий (FIGO) (Barakat et al., 2002)

Рисунок 12. Рак шейки матки VIA стадии (FIGO) (Barakat et al., 2002)

Рисунок 13. Рак шейки матки IIIB стадии (FIGO) (Barakat et al., 2002)
Морфологическая классификация предопухолевых заболеваний и злокачественных опухолей шейки матки
I. Предопухолевые заболевания и злокачественные опухоли эпителиального происхождения:
A. Изменения плоского эпителия:
1. Дисплазия шейки матки и рак in situ (CIN):
a) легкая (CIN I),
b) умеренная (CIN II),
c) тяжелая (CIN III),
d) рак in situ (CIN III).
2. Плоскоклеточный рак:
a) ороговевающий,
b) неороговевающий,
c) веррукозный,
d) кондиломатозный,
e) папиллярный,
f) лимфоэпителиальный.
B. Изменения железистого эпителия:
1. Дисплазия железистого эпителия.
2. Аденокарцинома in situ.
3. Аденокарцинома:
a) муцинозная::
— эндоцервикального типа,
— кишечного типа,
b) эндометриоидная,
c) светлоклеточная,
d) серозная,
e) из остатков вольфовых протоков.
C. Другие эпителиальные опухоли:
1. Железисто-плоскоклеточный рак.
2. Зернисто-клеточный рак.
3. Аденокистозный рак.
4. Аденобазальный рак.
5. Карциноиды.
6. Мелкоклеточный рак.
7. Недифференцированный рак.
II. Злокачественные опухоли мягких тканей:
A. Эндоцервикальная стромальная саркома.
B. Эмбриональная рабдомиосаркома.
C. Эндометриальная стромальная саркома.
D. Альвеолярная саркома мягких тканей.
E. Другие.
III. Опухоли смешанного происхождения:
A. Аденосаркома.
B. Карциносаркома.
C. Опухоль Вильмса.
IV. Другие злокачественные опухоли:
A. Меланома.
B. Гемобластозы.
C. Опухоль желточного мешка.
V. Метастатические опухоли.
Как правило, клиническая стадия РШМ устанавливается до начала специальной терапии, что необходимо для выбора метода и составления плана лечения. Коррекция клинической стадии заболевания возможна только в процессе первичного лечения, когда больной выполняется операция.
Лечение
Выбор метода лечения РШМ определяется индивидуально и зависит от распространенности процесса и тяжести сопутствующей соматической патологии. Возраст больной имеет меньшее значение. Традиционными методами лечения РШМ являются хирургический, лучевой и их комбинация. В настоящее время активно изучаются возможности лекарственной и химиолучевой терапии.
Хирургическое лечение
История хирургического лечения инвазивного РШМ насчитывает более 100 лет. Первые операции были выполнены в Европе и России во второй половине XIX в. Приоритет разработки и внедрения радикальных хирургических вмешательств при РШМ, безусловно, принадлежит австрийскому гинекологу Вертгейму (Wertheim) и датируется 1902 г. В монографии 1911 г. “Расширенная абдоминальная операция при раке шейки матки” Вертгейм описал результаты 500 расширенных гистерэктомий. В XX в. ряд выдающихся отечественных и зарубежных гинекологов многие годы исследований посвятили усовершенствованию техники расширенных операций и повышению их радикальности. Усилиями А.Т. Губарева, И.Л. Брауде, Л.Л. Окинчица, Н.Н. Никольского, А.И. Сереброва, В.П. Тобилевича, Л.А. Новиковой, Я.В. Бохмана, В.П. Козаченко техника расширенной гистерэктомии при РШМ прочно укоренилась в отечественной онкогинекологии, а ее широкое внедрение позволило излечить десятки тысяч женщин. Весомый вклад в разработку отдельных этапов операции Вертгейма внесли зарубежные исследователи — Okabayashi (1921); Meigs (1944, 1951) и др.
При тяжелой дисплазии (CIN III) и внутриэпителиальном РШМ (рак in situ) выполняется раздельное диагностическое выскабливание слизистой оболочки полости матки и цервикального канала и конизация шейки матки. При гистологическом подтверждении диагноза приведенный объем хирургического вмешательства считается адекватным (Козаченко В.П. с соавт., 1995).
Самой ранней формой инвазивного РШМ является микроинвазивный. Первым морфологическим признаком микроинвазии опухоли в строму шейки матки служит образование патологических выступов на границе эпителия и стромы. Критериями, позволяющими стадировать микроинвазивный РШМ, являются глубина и распространенность микроинвазии. Таким образом, диагноз микроинвазивного РШМ устанавливается только на основании гистологического исследования. Адекватным минимальным хирургическим вмешательством, позволяющим диагностировать микроинвазию опухоли в строму шейки матки, является ее конизация. Становление понятия “микроинвазивный” РШМ продолжалось несколько десятилетий. В 1995 г. Международная федерация гинекологов и акушеров (FIGO) утвердила следующее определение: “Микроинвазивным считается РШМ, проникающий в строму на глубину не более 3 мм от базальной мембраны, при отсутствии рак